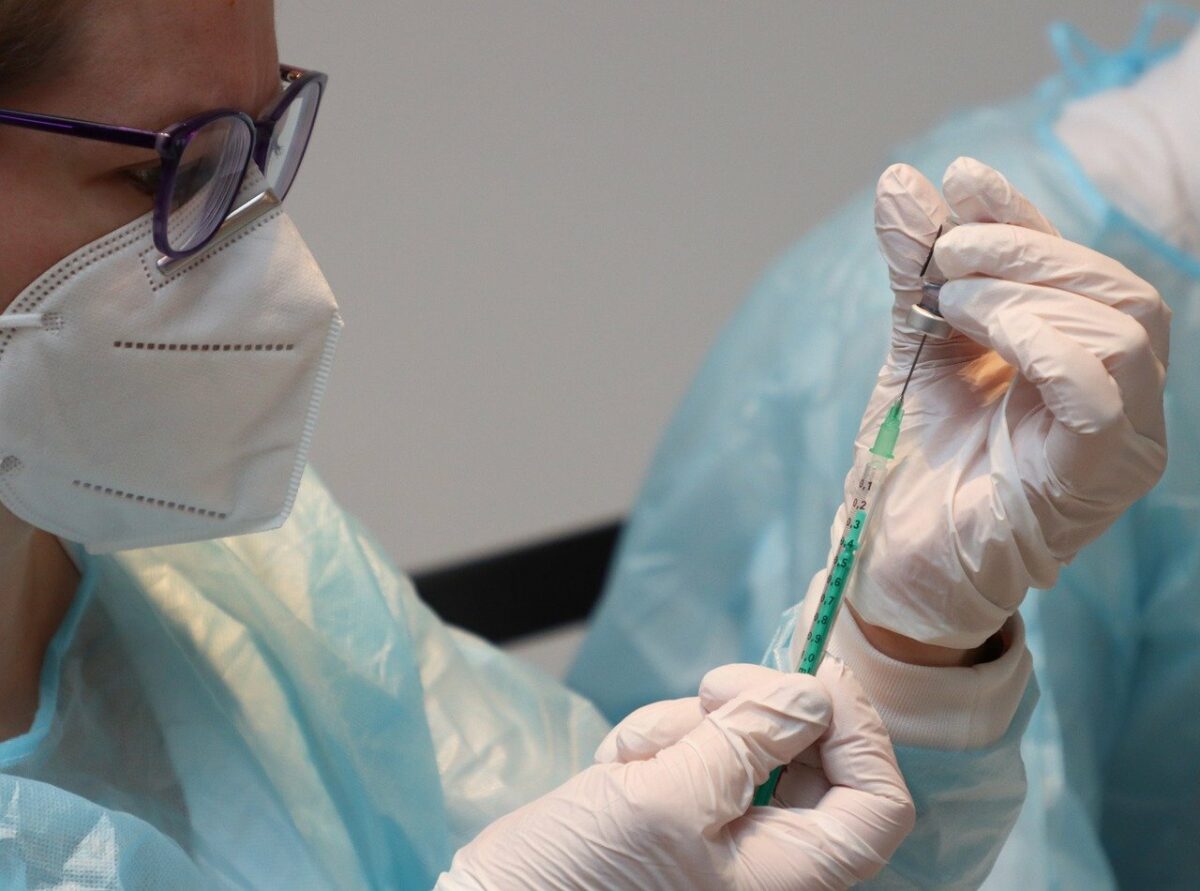
Auf dem Valneva-Impfstoff VLA2001 ruhen die Hoffnungen auch von vielen noch nicht geimpften Personen. Denn der Totimpfstoff arbeitet anders als die mRNA-Impfstoffe von BioNTech und Moderna. Am 10. November hatte die EU-Kommission 60 Millionen Impfstoffdosen von Valneva bestellt. Dies zeigt, dass es schon stark in Richtung Genehmigung des Impfstoffs geht! Und jetzt sehen wir ganz frisch die Mitteilung der EU-Arzneimittelbehörde EMA. Sie beginnt nun die „fortlaufende Prüfung“ des COVID-19-Impfstoff VLA2001 von Valneva.
Der Ausschuss für Humanarzneimittel (CHMP) der EMA hat demnach eine turnusmäßige Überprüfung von VLA2001 eingeleitet. Die Entscheidung des Ausschusses die turnusmäßige Überprüfung einzuleiten, stützt sich laut EMA auf vorläufige Ergebnisse aus Laborstudien (nicht-klinische Daten) und frühen klinischen Studien an Erwachsenen. Diese Studien deuten darauf hin, dass der Impfstoff von Valneva die Produktion von Antikörpern auslöst, die sich gegen SARS-CoV-2 richten, das Virus, das COVID-19 verursacht, und zum Schutz vor der Krankheit beitragen können.
Die EMA wird laut Mitteilung die Daten auswerten, sobald sie verfügbar sind, um zu entscheiden, ob der Nutzen die Risiken überwiegt. Die fortlaufende Prüfung werde fortgesetzt, bis genügend Beweise für einen formellen Zulassungsantrag vorliegen. Die EMA wird die Übereinstimmung von VLA2001 mit den üblichen EU-Standards für Wirksamkeit, Sicherheit und Qualität bewerten. Auch wenn die EMA die Gesamtdauer nicht vorhersagen kann, dürfte die Bewertung eines etwaigen Antrags von Valneva aufgrund der im Rahmen der fortlaufenden Prüfung geleisteten Arbeit weniger Zeit als üblich in Anspruch nehmen.
Die EMA wird weitere Mitteilungen machen, sobald der Zulassungsantrag für den Impfstoff eingereicht wurde. Wie wird der Impfstoff voraussichtlich wirken? Dazu sagt die EMA: „VLA2001 soll den Körper darauf vorbereiten, sich gegen eine Infektion mit SARS-CoV-2, dem Virus, das COVID-19 verursacht, zu wehren. Der Impfstoff enthält inaktiviertes (abgetötetes) SARS-CoV-2, das die Krankheit nicht auslösen kann. VLA2001 enthält außerdem zwei „Adjuvantien“, d. h. Stoffe, die die Immunreaktion auf den Impfstoff verstärken. Wenn eine Person den Impfstoff erhält, erkennt ihr Immunsystem das inaktivierte Virus als fremd und bildet Antikörper dagegen. Wenn die geimpfte Person später mit SARS-CoV-2 in Kontakt kommt, erkennt das Immunsystem das Virus und ist bereit, es abzuwehren.“
Die Valneva-Aktie reagiert im Handel bei Tradegate seit Veröffentlichung der EMA vor wenigen Minuten nur mit ein paar Cents im Plus.
Kommentare lesen und schreiben, hier klicken










Bin mir sicher, der EMA fällt etwas ein um die Zulassung auf den Sankt NimmerleinsTag zu verzögern. Wo kämen wir denn sonst hin, dann würde niemand mehr das andere Zeug sich spritzen lassen. Dabei soll jeder unbedingt gerade dieses mRNA Produkt aus ganz bestimmten Gründen bekommen. Auf die möchte ich nicht weiter eingehen. Haben aber nichts mit Gesundheit zu tun.
Puuh, diese Sorge habe ich „irgendwie“ auch. Doch wir haben aktuell auch einen Impfstoff-Engpass und ich kann mir vorstellen (also ich weiß es nicht),dass bei Impfstoffkonzepte nicht kompatibel mit einander sind. In China, Indien gibt es ja bereits von den dortigen Behörden zugelassene Tod-Impfstoffe. Es fällt mir schwer zu glauben, dass die EMA dann nicht einen großes Verzögerungspotenzial hat. Aber, aber….
Eine übergeordnete Stelle der Zulassungsstelle bestellt 60 Millionen Impfdosen.Zudem konnte man lesen,dass ein beschleunigtes Zulassungsverfahren erfolgt. Die Zulassung ist also nur eine Frage der Zeit und nicht der Wirkung. Die Unabhängigkeit der Zulassugsstelle kann dann mit den Notenbanken verglichen werden, die anscheinend auch unabhängig sein sollten.
Die schnell entwickelten Impfstoffe mit Notfallzulassung haben eine Ähnlichkeit mit dem ERSTMALIGEN EXPERIMENT MIT UNGEWISSEM AUSGANG der Notenbanken.Die FED hat immerhin bemerkt,dass die mittelfristigen Nebenwirkungen schon beträchtlich sind, die langfristigen sind immer noch ungewiss.